
Base bioquímica.
Introducción.
En 2015, Barex desarrolló el medio de conservación de semen de conejo Lepex, que ha estado en el mercado desde entonces. Recientemente, nuevos conocimientos sobre los mecanismos bioquímicos relacionados con la reproducción del conejo llevaron al diseño del nuevo suplemento Novum (Novum de New Ovulation Medium). El suplemento Novum, cuando se añade al diluyente de semen, es una forma innovadora de apoyar la inducción de la ovulación. Los ingredientes presentes en Novum están específicamente diseñados para ayudar a la proteína beta del factor de crecimiento nervioso (NGF), presente de forma natural en el semen del macho, a inducir la ovulación. Al apoyar diferentes mecanismos moleculares implicados en el proceso natural de ovulación, Novum permite la ovulación natural inducida por el apareamiento. En los siguientes párrafos, profundizaremos en los elementos cruciales del desarrollo de Novum y proporcionaremos detalles intrincados sobre los procesos moleculares de la reproducción en conejos.
Los conejos europeos son pequeños mamíferos pertenecientes a la familia Leporidae. Fueron cazados y comidos por los homínidos durante la Edad de Piedra en grandes cantidades en las zonas del noroeste del Mediterráneo, desde España hasta Italia. Los fenicios, que comerciaban por toda la zona mediterránea desde Chipre hasta la Península Ibérica, probablemente iniciaron la propagación del conejo. Los romanos descubrieron el conejo como fuente de alimento, y el comercio en el Imperio Romano propagó aún más los conejos desde la Península Ibérica a otras partes del mundo. La domesticación no se produjo hasta el siglo XVIII. Hoy en día, los conejos se crían más grandes y gordos para obtener más carne. Se introducen en todo el mundo en muchas culturas y forman parte de la vida cotidiana como alimento, vestido, compañía y fuente de inspiración artística. Los conejos se utilizan como modelo de investigación en la ciencia fundamental, y en la ciencia aplicada, los conejos se utilizan, entre otras cosas, para la producción de anticuerpos que pueden utilizarse en humanos o para estudiar enfermedades humanas.
2. Producción de carne de conejo.
El conejo es una buena fuente de carne para satisfacer la demanda de proteína animal. Con un programa de cría óptimo, una coneja (hembra) puede producir 60 conejos jóvenes al año, lo que representa más de 100 kg de carne de conejo. Además, los conejos tienen una alta tasa de reproducción en comparación con otros animales de granja. Alcanzan la madurez sexual antes, tienen un período de gestación relativamente corto y pueden volver a criarse inmediatamente después del parto. La inseminación artificial (IA) de conejas apareció en las granjas europeas a finales de la década de 1980. Se utilizó antes para obtener la mejora genética de los animales y resolver problemas sanitarios. Posteriormente se lograron mejoras significativas en los aspectos productivos y económicos. La técnica de la inseminación artificial de conejos sigue evolucionando.

Estimados colegas:
En las próximas décadas, la demanda de productos ganaderos aumentará con el espectacular aumento de la población mundial, además de que los consumidores serán más conscientes y exigirán productos de alta calidad. La cría de conejos, particularmente importante en la zona mediterránea y en las zonas semiáridas de África, Asia o América, representa una valiosa fuente alternativa de proteína animal de buena calidad (baja en grasas y baja en colesterol). Como los conejos están siendo elegidos, en todo el mundo, como una especie ganadera debido a sus ventajas reproductivas y alimentarias, la cría moderna de conejos se enfrentará a algunos retos importantes en el futuro que deben resolverse en los próximos años para garantizar que siga siendo un sector competitivo y sostenible. Deben utilizarse diferentes estrategias para mantener un equilibrio entre el bienestar de los conejos, las demandas de los clientes y los requisitos de los criadores. Es necesario mejorar los sistemas de cría, lo que puede implicar evitar las hormonas y los antibióticos; mejorar la eficiencia de los procedimientos reproductivos, como los sistemas de inseminación artificial o la congelación de semen y embriones, entre otros; prolongar la vida productiva de las conejas; y ajustar los sistemas nutricionales para optimizar el estado fisiológico de los animales. Este número especial tenía como objetivo publicar manuscritos de alta calidad, incluyendo estudios de investigación originales y revisiones, que aborden principalmente cualquiera de estos temas para aumentar la productividad y la sostenibilidad de los conejos.
Dra. Rosa María García-García
Dra. María Arias Álvarez
Editores invitados
3. Inseminación artificial en conejos.
El uso comercial de la IA en la cría de conejos es relativamente reciente. El uso a gran escala de la IA en la cría de conejos comenzó a finales de la década de 1980. Gracias a la IA de conejos, es posible aumentar el volumen de productos de alta calidad obtenidos con bajos costes de mano de obra, en contraposición al uso del apareamiento natural. Crear condiciones de calidad para mantener un pequeño número de machos es más fácil. Las tasas de concepción después de la IA con semen fresco son equivalentes o incluso mejores que las obtenidas por el apareamiento natural.
Otras ventajas son: se puede controlar la calidad de la descendencia, aumentar el número de individuos con características valiosas y funcionales, prolongar la fertilidad incluso durante épocas desfavorables del año, producción basada en el ciclo durante todo el año y programas de cría más eficientes.
La IA se utilizó antes, antes de las aplicaciones a gran escala, para obtener la mejora genética de los animales y resolver problemas sanitarios. Sin embargo, posteriormente se lograron mejoras significativas tanto en los aspectos productivos como económicos, como la aceleración de los rasgos deseables de alto valor genético apoyados por la conservación del semen.
El uso sistemático de la IA en la producción intensiva de conejos es uno de los enfoques más eficaces para distribuir los eyaculados de machos de calidad o valor genético superior. En resumen: la IA ofreció a las grandes granjas la oportunidad de optimizar las condiciones para la producción altamente económica de carne de conejo.
Muchos mamíferos sostienen que la ovulación está regulada por los esteroides ováricos liberados de los ovarios maduros. Estos esteroides provocan la liberación de la hormona liberadora de gonadotropina (GnRH) del hipotálamo. Estos mamíferos se denominan ovuladores espontáneos.
Los conejos, sin embargo, son ovuladores inducidos. Esto significa que la ovulación es inducida por el apareamiento, que desencadena la secreción de GnRH. Por lo tanto, cuando se utiliza la IA en lugar del apareamiento natural en la cría de conejos a gran escala, se debe aplicar una hormona liberadora de gonadotropina (GnRH) para inducir la ovulación.
La aplicación de GnRH puede realizarse de varias maneras, pero se realiza principalmente mediante inyección intramuscular de la coneja o administración intravaginal.
Ejemplos de GnRH sintética disponible comercialmente como medicamentos veterinarios son Receptal de MSD Animal Health (parte de Merck & Co, con sede en EE. UU.) y Dalmarelin de Fatro (con sede en Italia). Receptal contiene 4,2 mcg de buserelina por ml, y Dalmarelin contiene 25 mcg de lecirelina por ml.
Después de la inyección intramuscular, el agonista se absorbe en los vasos sanguíneos del tejido muscular y se distribuye en el sistema. Respuesta inmediata….
La entrada del agonista en la sangre provoca una liberación inmediata de la hormona luteinizante de la hipófisis anterior, lo que provoca la ovulación.
Se necesita aproximadamente diez veces más agonista para la administración intravaginal, ya que las moléculas de GnRH necesitan pasar la pared vaginal para llegar a los vasos sanguíneos. Además del paso por la pared, el entorno vaginal es hostil a las proteínas externas.


5- La Hormona GnRH
Una hormona es una sustancia reguladora producida en un organismo y transportada en fluidos tisulares como la sangre para estimular células o tejidos específicos para que actúen. Una hormona gonadotropina es una hormona que actúa sobre o estimula las gónadas, es decir, un órgano que produce espermatozoides (testículos) o óvulos (ovarios).
La hormona liberadora de gonadotropina (GnRH) es una hormona liberadora responsable de la liberación de la hormona folículo estimulante (FSH) y la hormona luteinizante (LH) de la hipófisis anterior. La GnRH es una hormona peptídica trópica sintetizada y liberada por las neuronas de GnRH dentro del hipotálamo.
La GnRH es una pequeña proteína o péptido que consta de 10 aminoácidos.
La identidad de la GnRH fue aclarada por los premios Nobel de 1977 Roger Guillemin y Andrew V. Schally. La vida media de la GnRH es de solo 2-4 minutos, ya que la molécula se degrada rápidamente por las enzimas proteolíticas, también llamadas peptidasas. La corta vida media fue la razón por la que se han sintetizado análogos de GnRH para aumentar su potencia y duración de acción para aplicaciones como medicamentos humanos.
Para la administración a mamíferos, se utiliza GnRH sintética. Estas moléculas se denominan agonistas o análogos de GnRH. La GnRH sintética se utiliza para inducir la ovulación en conejos. Estas moléculas se denominan agonistas o análogos de GnRH. Los análogos difieren ligeramente del decapéptido de GnRH natural (humano) pero con modificaciones específicas. Estas modificaciones son sustituciones simples o dobles de aminoácidos específicos (en la posición 6 del aminoácido). Pero también se producen cambios en la posición 9 (alquilación) o la eliminación de la posición diez. Estas modificaciones pueden inhibir la rápida degradación en los fluidos corporales manteniendo la función. Los agonistas con dos sustituciones de aminoácidos son la leuprorelina, la buserelina, la goserelina y la deslorelina. Los agentes nafarelina y triptorelina son agonistas con sustituciones simples en la posición 6.
6. Ovulación inducida por NGF como alternativa.
Hasta hace pocos años, se pensaba que la ovulación en conejos solo podía ser inducida por la cópula. La noción era que el mecanismo principal implicado en la liberación de GnRH entre los ovuladores inducidos consiste en la activación de las neuronas noradrenérgicas en respuesta a las señales somatosensoriales genitales generadas al recibir una intromisión de un macho durante el apareamiento. Estas neuronas noradrenérgicas promoverían entonces la liberación de GnRH. Sin embargo, investigaciones recientes sobre la base molecular de la reproducción en conejos indican que la proteína beta del factor de crecimiento nervioso (NGF) desempeña un papel vital como factor inductor de la ovulación.
El factor de crecimiento nervioso (NGF) es una proteína y un factor neurotrófico que regula el crecimiento, el mantenimiento, la proliferación y la supervivencia de neuronas diana específicas. Pero muchos años después de su descubrimiento, quedó claro que el NGF también desempeña un papel vital en la reproducción, particularmente en las especies inducidas por la ovulación.
El efecto del NGF en las células diana está mediado por dos receptores: el receptor de tirosina quinasa A (TrKA), que se une selectivamente.
NGF, y el receptor de neurotrofina p75. Estos receptores se encuentran en varios lugares del tracto reproductivo de la coneja.
A través de la interacción con los receptores, la proteína NGF induce la ovulación, pero también afecta al tracto reproductivo de la coneja durante y después de la ovulación. Además, también tiene un papel en el entorno bioquímico durante el desarrollo embrionario temprano.
El NFG puede actuar como un factor de inducción ovulatoria por dos tipos de mecanismos en el tracto reproductivo femenino. En primer lugar, el NGF puede estimular las neuronas sensoriales uterinas y cervicales, que desencadenan las neuronas en el hipotálamo. En segundo lugar, el NGF puede causar la síntesis adicional de NGF en el tracto reproductivo, que, junto con el derivado del semen, es transportado por la sangre y se dirige al cerebro con la liberación final de GnRH.
La evidencia más convincente del papel crítico del NFG es que el NGF sintético (una proteína recombinante idéntica al NGF que se encuentra en los conejos) añadido al semen diluido induce la ovulación y la concepción por la vía intravaginal. La ovulación se genera de forma dependiente de la dosis. Hubo descendencia sana sin diferencia en comparación con la GnRH.
Surge la siguiente imagen. Aproximadamente 1 ml de eyaculado que contiene alrededor de 300 millones de espermatozoides suspendidos en plasma seminal que contiene NGF se deposita durante el apareamiento. A través de la acción del NGF, se inicia una serie de varias funciones moleculares y celulares. Cuando los espermatozoides llegan al oviducto, en cuestión de minutos en los conejos, solo un pequeño número de espermatozoides se adhieren al epitelio del oviducto. La ovulación se induce aproximadamente diez horas después del coito, y la fertilización ocurre 2-3 horas después de la ovulación. Todos estos eventos resultan de la interacción endocrina y neuronal conectada al apareamiento, con el NFG jugando un papel fundamental.
El NGF presenta una alternativa al uso de GnRH. Además, se espera que el NGF juegue un papel esencial en el futuro de la IA en muchos otros animales.
7. ¿La matriz en Lepex mejora el funcionamiento de la ovulación inducida por NGF?
El diluyente de semen de conejo Lepex contiene Matrix, un polímero. Como se escribió anteriormente, este diluyente se desarrolló en 2015 y se utilizó en la estación de IA de conejos Peter Rutjens. En experimentos recientes que tenían como objetivo el uso de péptidos antibacterianos específicos, se observó un buen rendimiento sin el uso de la inyección intramuscular de un análogo de GnRH. Esto nos hizo suponer que Matrix, de una forma u otra, mejoró el funcionamiento de la ovulación inducida por NGF.
El mecanismo molecular de Matrix en la aplicación del diluyente es múltiple; primero, las células espermáticas se grapan menos; segundo, hay menos reflujo de semen diluido después de la inseminación; y tercero, y lo más importante, Matrix actúa como mucoadhesivo. En ese momento, supusimos que el resultado positivo inesperado de nuestros experimentos fue causado por la mejora de la ovulación mediada por NGF en conejos, con un papel primordial de Matrix.
Matrix, un nuevo papel en la aplicación de NGF
En 2012 y 2013, Barex investigó diferentes polímeros para aplicar en medios de conservación para semen de cerdo para evitar la precipitación de las células en la dilución por la presencia en el medio de la red tridimensional del polímero. Esto sería entonces análogo a la acción de los carragenanos poliméricos en la leche con chocolate, que evita la precipitación de las partículas de cacao.
Barex comenzó con una colección de varias docenas de polímeros. Después de la selección por investigación in vitro, a saber, el análisis de la motilidad espermática durante el almacenamiento utilizando el sistema de análisis de semen asistido por ordenador CEROS II de Hamilton Thorne, se nos ocurrieron tres candidatos potenciales. Después de una selección adicional utilizando pruebas de inseminación, quedó un solo polímero con un rango específico de pesos moleculares. Este polímero se llamó Matrix.
Matrix se probó ampliamente en cerdos. Los primeros experimentos indicaron que una sola inseminación era suficiente para que las cerdas quedaran preñadas, en contraste con la práctica actual de dos inseminaciones. Matrix en el medio de dilución para semen de cerdo se probó durante más de dos años en varias granjas de los Países Bajos. La conclusión fue que con una sola inseminación, el medio con Matrix aumentó la tasa de partos en un 2-4% y aumentó el tamaño de la camada en 0,9 -1,7 lechones por camada.
Desafortunadamente, las grandes empresas que producen y venden diluyentes de semen y consumibles para la IA no estaban interesadas en Matrix porque siempre reduciría significativamente su facturación. Después de todo, solo se necesitaba una inseminación una vez en lugar de dos.
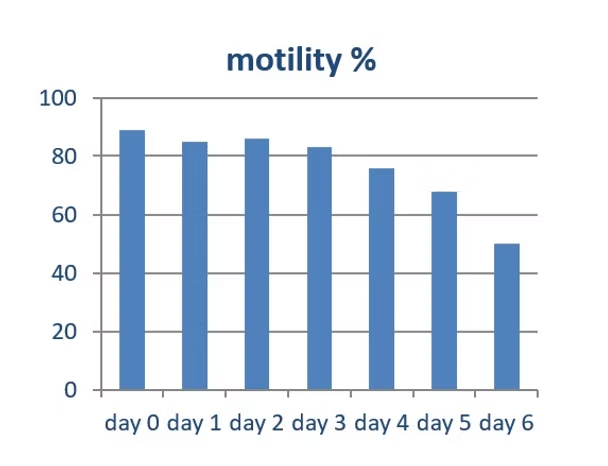
Después de investigar el uso de Matrix en diluyentes de semen de cerdo, Barex comenzó a desarrollar un diluyente de semen de conejo. En 2015, Barex creó con éxito Lepex. La imagen de abajo demuestra la motilidad de los espermatozoides de conejo diluidos en Lepex durante el almacenamiento a 17°C.
Matrix mostró un efecto positivo en la capacidad de almacenamiento de Lepex. Este y otros experimentos mostraron que Lepex tiene una mejor capacidad de almacenamiento que otros diluyentes de semen de conejo comerciales.
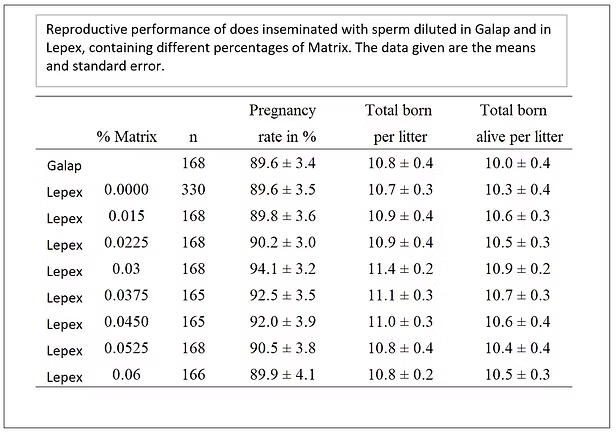
Se esperaba que Matrix también tuviera un efecto positivo en el rendimiento reproductivo de los conejos. Después de varios experimentos exploratorios, el porcentaje óptimo de Matrix se determinó en un ensayo de campo a gran escala.
La imagen de abajo muestra los resultados. A una concentración óptima de Matrix, la tasa de embarazo es un 4-5% más alta, y el tamaño de la camada nacida viva es casi uno más alto en comparación con un diluyente sin Matrix.
Porex, porexcell y pronexcell.
Hace muchos años, Barex descubrió accidentalmente el efecto positivo de los aislados de suero de leche en la capacidad de almacenamiento de los diluyentes de semen porcino. La adición del 1% de una marca particular de aislado de suero de leche se denominó Porex. Porex se probó en TRIXCell, el diluyente de IMV Technologies. TRIXcell+ era el diluyente con Porex. Durante los seis años de ensayos de inseminación, las 35 granjas que participaron tuvieron cada año una mayor tasa de partos y un mayor número de lechones nacidos vivos cuando se utilizó TRIXcell+ en lugar de BTS, el diluyente de referencia, lo que resultó en una mayor tasa de partos y un mayor tamaño de la camada.
TRIXcell+ mostró un aumento promedio en el número de lechones nacidos vivos de 0,6. Estudios anteriores indicaron que TRIXcell tenía un rendimiento similar en cuanto a tasa de partos y tamaño de la camada a BTS (Haugan et al., 2007).
El aditivo al diluyente se denominó Porex. Una mejora adicional de Porex fue la adición de lecitina de soja. Con la adición, el nombre se cambió a Porexcell. Tanto Porex como Porexcell se han utilizado durante muchos años en diluyentes de semen porcino.
Alrededor de 2014, se hizo evidente que el efecto positivo de Porexcell se redujo e incluso impactó negativamente en la capacidad de conservación de los diluyentes de semen porcino. Resultó que contenía cada vez más pesticidas con el paso de los años. Este efecto negativo en la motilidad durante el almacenamiento del esperma diluido no se notó en los diluyentes de semen de semental o en los diluyentes de semen de conejo. Parece que las células espermáticas porcinas son muy susceptibles a los pesticidas. Se realizaron esfuerzos para desarrollar un producto sin pesticidas; dado que no queríamos que el desarrollo afectara a las células espermáticas de semental y conejo, finalmente, cambiamos a una mezcla de proteínas derivada de la leche, pero más pura que la proteína de suero de leche. El nuevo producto se denominó Pronexcell. Hasta el día de hoy, Pronexcell se utiliza en los diluyentes de semen Hippex para esperma de semental y en Lepex, el diluyente de esperma de conejo.
Los efectos positivos de estas proteínas se suman al rendimiento de Matrix.
8. Matrixcell.
Los resultados de los experimentos iniciales indicaron que Novum funciona muy bien. Se tuvieron que añadir ingredientes adicionales para alcanzar un rendimiento similar al del uso de GnRH. Como se ha escrito anteriormente, la proteína NGF interactúa con dos receptores, TrkA y p75, que se pueden encontrar en todo el tracto reproductor femenino para inducir la ovulación. Son necesarias múltiples activaciones de receptores, y la respuesta es directamente proporcional al número de encuentros NGF-receptor por unidad de tiempo. La transducción de señales eficaz requiere concentraciones adecuadas y un entorno bioquímico adecuado. Un diluyente de esperma tiene un entorno bioquímico muy diferente al del moco vaginal. La superficie del tracto reproductor femenino está cubierta de moco, un gel viscoelástico complejo que actúa como la primera línea de defensa contra agentes dañinos del entorno exterior. El moco desempeña un papel esencial en muchas funciones biológicas. El moco alberga la flora vaginal, fundamental para mantener la barrera mucosa vaginal. Para mejorar la mezcla de esperma diluido con moco y para permitir que NGF interactúe con sus receptores, Matrixcell es uno de los ingredientes críticos de Novum.
Matrixcell.
La entrega de NGF en el sitio de los receptores en el tracto reproductor femenino puede verse afectada por el moco en numerosos pliegues, cavidades y crestas en el epitelio, lo que aumenta el área de la superficie de la vagina y proporciona distensibilidad. Además, las fugas pueden reducir la cantidad de NGF disponible para la interacción con los receptores. Con la aplicación de IA, hay menos dinámica de fluidos vaginales y fuerzas biomecánicas naturales que con el apareamiento natural.
Por lo tanto, la eficacia de la actividad de NGF depende de concentraciones adecuadas y retención en la superficie de las paredes del tracto reproductor. Matrix mucoadhesivo demostró ser exitoso, prolongando la presencia de NGF en la mucosa al formar enlaces físicos y químicos con el moco. Sin embargo, para mejorar la penetración de NGF en el moco, se utilizó Matrixcell, que es una forma más pura y refinada de Matrix.
La penetración del moco abarca diferentes fases. La primera establece un contacto íntimo entre el medio de inseminación y el moco e implica la dispersión del medio. En la segunda fase, se produce una interpenetración entre los polímeros de Matrix y las glicoproteínas del moco mediante la formación de enredos físicos entre las dos especies macromoleculares. En particular, Matrixcell funciona mejor que Matrix en esta fase, como se indica en experimentos in vitro. En la tercera fase, se produce la consolidación, fortaleciendo la unión polímero de Matrix-mucina mediante la creación de fuerzas de Van der Waals y enlaces de hidrógeno.

9. Vida media de NGF
La presencia de peptidasas tanto en el semen diluido como en el tracto reproductor femenino afecta la vida media de NGF en la dosis de inseminación. Las peptidasas se encuentran en el plasma seminal de conejo, principalmente provenientes del epidídimo y las glándulas sexuales accesorias, mientras que los microbios colonizan el tracto reproductor femenino y también secretan peptidasas. Tanto el esperma como el fluido vaginal contienen enzimas degradantes de proteínas.
Matrixcell, presente en el diluyente, actúa como un gel para extender la vida media de NGF. Además, la vida media de las proteínas NGF se extendió añadiendo un cóctel de inhibidores de enzimas degradantes de proteínas, péptidos competidores y proteínas (a.o., Pronexcell).
10. Observaciones finales
Los nuevos conocimientos sobre la reproducción de conejos condujeron al desarrollo del nuevo suplemento diluyente de semen Novum. Los diversos ingredientes únicos de Novum apoyan los mecanismos moleculares que conducen a la ovulación y al embarazo en conejos. El excelente rendimiento de Novum ha sido confirmado por varios experimentos en diferentes lugares de varios países.

