
Background biochimico.
Introduzione.
Nel 2015, Barex ha sviluppato il terreno di conservazione dello sperma di coniglio Lepex, che da allora è sul mercato. Recentemente, nuove conoscenze sui meccanismi biochimici legati alla riproduzione del coniglio hanno portato alla progettazione del nuovo integratore Novum (Novum da New Ovulation Medium). L’integratore Novum, quando aggiunto all’extender per lo sperma, è un modo rivoluzionario per supportare l’induzione dell’ovulazione. Gli ingredienti presenti in Novum sono specificamente progettati per assistere la proteina beta nerve growth factor (NGF) naturalmente presente nello sperma del maschio nell’induzione dell’ovulazione. Supportando diversi meccanismi molecolari coinvolti nel processo di ovulazione naturale, Novum consente l’ovulazione naturale indotta dall’accoppiamento. Nei paragrafi seguenti, approfondiremo gli elementi cruciali dello sviluppo di Novum e forniremo dettagli intricati sui processi molecolari della riproduzione nei conigli.
I conigli europei sono piccoli mammiferi appartenenti alla famiglia dei Leporidi. Furono cacciati e mangiati dagli ominidi durante l’età della pietra in gran numero nelle aree nord-occidentali del Mediterraneo, dalla Spagna all’Italia. I Fenici, che commerciavano in tutta l’area del Mediterraneo da Cipro alla penisola iberica, probabilmente iniziarono la diffusione del coniglio. I Romani scoprirono il coniglio come fonte di cibo e il commercio nell’Impero Romano diffuse ulteriormente i conigli dalla penisola iberica ad altre parti del mondo. La domesticazione avvenne fino al XVIII secolo. Oggi, i conigli sono allevati più grandi e grassi per ottenere più carne. Sono introdotti in tutto il mondo in molte culture e fanno parte della vita quotidiana come cibo, abbigliamento, compagnia e fonte di ispirazione artistica. I conigli sono usati come modello di ricerca nella scienza fondamentale e, nella scienza applicata, i conigli sono usati, tra l’altro, per la produzione di anticorpi che possono essere usati negli esseri umani o per studiare le malattie umane.
2. Produzione di carne di coniglio.
Il coniglio è una buona fonte di carne per soddisfare la domanda di proteine animali. Con un programma di allevamento ottimale, una coniglia (femmina) può produrre 60 coniglietti all’anno, che rappresentano oltre 100 kg di carne di coniglio. Inoltre, i conigli hanno un alto tasso di riproduzione rispetto ad altri animali da allevamento. Raggiungono la maturità sessuale prima, hanno un periodo di gestazione relativamente breve e possono essere re-fecondati immediatamente dopo il parto. L’inseminazione artificiale (IA) delle coniglie è apparsa nelle aziende agricole europee alla fine degli anni ’80. In precedenza, veniva utilizzata per ottenere il miglioramento genetico degli animali e risolvere problemi sanitari. Successivamente, sono stati raggiunti miglioramenti significativi riguardanti sia gli aspetti produttivi che economici. La tecnica dell’inseminazione artificiale dei conigli continua ad evolversi.

Cari colleghi,
Nei prossimi decenni, la domanda di prodotti zootecnici aumenterà con il drammatico aumento della popolazione mondiale, oltre al fatto che i consumatori diventeranno più consapevoli ed esigeranno prodotti di alta qualità. L’allevamento di conigli, particolarmente importante nell’area mediterranea e nelle zone semi-aride di Africa, Asia o America, rappresenta una preziosa fonte alternativa di proteine animali di buona qualità (a basso contenuto di grassi e colesterolo). Poiché i conigli sono scelti, in tutto il mondo, come specie da allevamento grazie ai loro vantaggi riproduttivi e alimentari, l’allevamento moderno di conigli dovrà affrontare alcune importanti sfide future che dovranno essere risolte nei prossimi anni per garantire che rimanga un settore competitivo e sostenibile. Diverse strategie dovrebbero essere utilizzate per mantenere un equilibrio tra il benessere dei conigli, le richieste dei clienti e le esigenze degli allevatori. È necessario un miglioramento dei sistemi di allevamento, che può comportare l’evitare ormoni e antibiotici; migliorare l’efficienza delle procedure riproduttive come i sistemi di inseminazione artificiale o il congelamento di sperma ed embrioni, tra gli altri; estendere la durata produttiva delle coniglie; e adeguare i sistemi nutrizionali per ottimizzare lo stato fisiologico degli animali. Questo numero speciale mirava a pubblicare manoscritti di alta qualità, inclusi studi di ricerca originali e recensioni, che affrontassero principalmente uno qualsiasi di questi argomenti nell’aumentare la produttività e la sostenibilità dei conigli.
Dott.ssa Rosa María García-García
Dott.ssa Maria Arias Alvarez
Guest editor
3. Inseminazione artificiale nei conigli.
L’uso commerciale dell’IA nell’allevamento di conigli è relativamente recente. L’uso su larga scala dell’IA nell’allevamento di conigli è iniziato alla fine degli anni ’80. Grazie all’IA dei conigli, è possibile aumentare il volume di prodotti di alta qualità ottenuti con bassi costi di manodopera, rispetto all’uso dell’accoppiamento naturale. Creare condizioni di qualità per mantenere un piccolo numero di maschi è più facile. I tassi di concepimento dopo l’IA con sperma fresco sono equivalenti o addirittura migliori di quelli ottenuti con l’accoppiamento naturale.
Ulteriori vantaggi sono: si può controllare la qualità della prole, aumentare il numero di individui con caratteristiche funzionali preziose, prolungare la fertilità anche durante periodi sfavorevoli dell’anno, produzione basata su cicli annuali e programmi di allevamento più efficienti.
L’IA è stata utilizzata in precedenza, prima delle applicazioni su larga scala, per ottenere il miglioramento genetico degli animali e risolvere problemi sanitari. Tuttavia, sono stati raggiunti successivamente miglioramenti significativi sia negli aspetti produttivi che economici, come l’accelerazione dei tratti desiderabili di alto valore genetico supportati dalla conservazione dello sperma.
L’uso sistematico dell’IA nella produzione intensiva di conigli è uno degli approcci più efficaci per distribuire gli eiaculati di maschi di qualità o valore genetico superiore. In breve: l’IA ha offerto alle grandi aziende agricole l’opportunità di ottimizzare le condizioni per la produzione altamente economica di carne di coniglio.
Molti mammiferi ritengono che l’ovulazione sia regolata dagli steroidi ovarici rilasciati dalle ovaie mature. Questi steroidi provocano il rilascio dell’ormone di rilascio delle gonadotropine (GnRH) dall’ipotalamo. Questi mammiferi sono chiamati ovulatori spontanei.
I conigli, tuttavia, sono ovulatori indotti. Ciò significa che l’ovulazione è indotta dall’accoppiamento, che innesca la secrezione di GnRH. Pertanto, quando si utilizza l’IA invece dell’accoppiamento naturale nell’allevamento di conigli su larga scala, è necessario applicare un ormone di rilascio delle gonadotropine (GnRH) per indurre l’ovulazione.
L’applicazione di GnRH può essere fatta in diversi modi, ma viene fatta principalmente attraverso l’iniezione intramuscolare della coniglia o la somministrazione intravaginale.
Esempi di GnRH sintetico disponibile in commercio come medicinali veterinari sono Receptal di MSD Animal Health (parte di Merck & Co con sede negli Stati Uniti) e Dalmarelin di Fatro (con sede in Italia). Receptal contiene 4,2 mcg di buserelin per ml e Dalmarelin contiene 25 mcg di lecirelin per ml
Dopo l’iniezione intramuscolare, l’agonista viene assorbito nei vasi sanguigni del tessuto muscolare e distribuito nel sistema. Risposta immediata….
L’ingresso dell’agonista nel sangue provoca un rilascio immediato di ormone luteinizzante dall’ipofisi anteriore, con conseguente ovulazione.
È necessaria una quantità di agonista circa dieci volte superiore per la somministrazione intravaginale, poiché le molecole di GnRH devono attraversare la parete vaginale per raggiungere i vasi sanguigni. Oltre al passaggio della parete, l’ambiente vaginale è ostile alle proteine esterne.


5- L’ormone GnRH
Un ormone è una sostanza regolatrice prodotta in un organismo e trasportata nei fluidi tissutali come il sangue per stimolare cellule o tessuti specifici all’azione. Un ormone gonadotropina è un ormone che agisce o stimola le gonadi, cioè un organo che produce spermatozoi (testicolo) o ovuli (ovaio).
L’ormone di rilascio delle gonadotropine (GnRH) è un ormone di rilascio responsabile del rilascio dell’ormone follicolo-stimolante (FSH) e dell’ormone luteinizzante (LH) dall’ipofisi anteriore. Il GnRH è unormone peptidico tropico sintetizzato e rilasciato dai neuroni GnRH all’interno dell’ipotalamo.
Il GnRH è una piccola proteina o peptide costituito da 10 amminoacidi.
L’identità del GnRH è stata chiarita dai premi Nobel del 1977 Roger Guillemin e Andrew V. Schally. L’emivita del GnRH è di soli 2-4 minuti poiché la molecola viene rapidamente degradata da enzimi proteolitici, chiamati anche peptidasi. La breve emivita è il motivo per cui sono stati sintetizzati analoghi del GnRH per aumentarne la potenza e la durata d’azione per applicazioni come medicinali umani.
Per la somministrazione ai mammiferi, viene utilizzato il GnRH sintetico. Queste molecole sono chiamate agonisti o analoghi del GnRH. Il GnRH sintetico viene utilizzato per indurre l’ovulazione nei conigli. Queste molecole sono chiamate agonisti o analoghi del GnRH. Gli analoghi differiscono leggermente dal decapeptide GnRH naturale (umano) ma con modifiche specifiche. Queste modifiche sono sostituzioni singole o doppie di specifici amminoacidi (nella posizione amminoacidica 6). Ma si verificano anche cambiamenti nella posizione 9 (alchilazione) o la delezione della posizione 10. Queste modifiche possono inibire la rapida degradazione nei fluidi corporei mantenendo la funzione. Gli agonisti con due sostituzioni di amminoacidi sono leuprorelina, buserelina, goserelina e deslorelina. Gli agenti nafarelina e triptorelina sono agonisti con singole sostituzioni nella posizione 6.
6. Ovulazione indotta da NGF come alternativa.
Fino a pochi anni fa, si pensava che l’ovulazione nei conigli potesse essere indotta solo dalla copulazione. L’idea era che il meccanismo primario coinvolto nel rilascio di GnRH tra gli ovulatori indotti consistesse nell’attivazione dei neuroni noradrenergici in risposta ai segnali somatosensoriali genitali generati dalla ricezione di un’intromissione da un maschio durante l’accoppiamento. Questi neuroni noradrenergici promuoverebbero quindi il rilascio di GnRH. Tuttavia, recenti ricerche sulle basi molecolari della riproduzione nei conigli indicano che la proteina beta Nerve Growth Factor (NGF) svolge un ruolo vitale come fattore di induzione dell’ovulazione.
Il fattore di crescita nervoso (NGF) è una proteina e un fattore neurotrofico che regola la crescita, il mantenimento, la proliferazione e la sopravvivenza di specifici neuroni bersaglio. Ma molti anni dopo la sua scoperta, è diventato chiaro che l’NGF svolge anche un ruolo vitale nella riproduzione, in particolare nelle specie a ovulazione indotta.
L’effetto dell’NGF sulle cellule bersaglio è mediato da due recettori: il recettore della tirosina chinasi A (TrKA), che si lega selettivamente.
NGF, e il recettore della neurotrofina p75. Questi recettori si trovano in diverse posizioni nel tratto riproduttivo della coniglia.
Attraverso l’interazione con i recettori, la proteina NGF induce l’ovulazione, ma influisce anche sul tratto riproduttivo della coniglia durante e dopo l’ovulazione. Inoltre, ha anche un ruolo nell’ambiente biochimico durante lo sviluppo embrionale precoce.
L’NFG può agire come fattore di induzione ovulatoria attraverso due tipi di meccanismi nel tratto riproduttivo femminile. In primo luogo, l’NGF può stimolare i neuroni sensoriali uterini e cervicali, che innescano i neuroni nell’ipotalamo. In secondo luogo, l’NGF può causare l’ulteriore sintesi di NGF nel tratto riproduttivo, che, insieme a quello derivante dallo sperma, viene trasportato dal sangue e prende di mira il cervello con l’ultimo rilascio di GnRH.
L’evidenza più convincente del ruolo critico dell’NFG è che l’NGF sintetico (una proteina ricombinante identica all’NGF presente nei conigli) aggiunto allo sperma diluito induce l’ovulazione e il concepimento per via intravaginale. L’ovulazione viene generata in modo dose-dipendente. C’erano prole sana senza differenze rispetto al GnRH.
Emerge il seguente quadro. Circa 1 mL di eiaculato contenente circa 300 milioni di spermatozoi sospesi nel plasma seminale contenente NGF viene depositato durante l’accoppiamento. Attraverso l’azione dell’NGF, viene avviata una serie di diverse funzioni molecolari e cellulari. Quando gli spermatozoi raggiungono l’ovidotto, entro pochi minuti nei conigli, solo un piccolo numero di spermatozoi si attacca all’epitelio oviduttale. L’ovulazione è indotta circa dieci ore dopo il coito e la fecondazione avviene 2-3 ore dopo l’ovulazione. Tutti questi eventi derivano dall’interazione endocrina e neuronale connessa all’accoppiamento, con l’NFG che svolge un ruolo fondamentale.
L’NGF presenta un’alternativa all’uso del GnRH. Inoltre, si prevede che l’NGF svolgerà un ruolo essenziale nel futuro dell’IA in molti altri animali.
7. La matrice in Lepex migliora il funzionamento dell’ovulazione indotta da NGF?
L’extender per sperma di coniglio Lepex contiene Matrix, un polimero. Come scritto sopra, questo extender è stato sviluppato nel 2015 e utilizzato presso la Peter Rutjens Rabbit AI Station. In recenti esperimenti volti all’uso di specifici peptidi antibatterici, è stata notata una buona performance senza l’uso di iniezione intramuscolare di un analogo del GnRH. Questo ci ha fatto supporre che Matrix, in un modo o nell’altro, migliorasse il funzionamento dell’ovulazione indotta da NGF.
Il meccanismo molecolare di Matrix nell’applicazione dell’extender è molteplice; in primo luogo, le cellule spermatiche si aggregano meno; in secondo luogo, c’è meno riflusso di sperma diluito dopo l’inseminazione; e terzo, e soprattutto, Matrix agisce come mucoadesivo. A quel punto, abbiamo supposto che l’inaspettato esito positivo dei nostri esperimenti fosse causato dal miglioramento dell’ovulazione mediata da NGF nei conigli, con un ruolo primario di Matrix.
Matrix, un nuovo ruolo nell’applicazione di NGF
Nel 2012 e 2013, Barex ha studiato diversi polimeri da applicare nei mezzi di conservazione per lo sperma di suino per prevenire la precipitazione delle cellule nella diluizione a causa della presenza nel mezzo della rete tridimensionale del polimero. Questo sarebbe quindi analogo all’azione dei carragenani polimerici nel latte al cioccolato, che impedisce la precipitazione delle particelle di cacao.
Barex ha iniziato con una collezione di diverse dozzine di polimeri. Dopo la selezione mediante ricerca in vitro, ovvero l’analisi della motilità degli spermatozoi durante la conservazione utilizzando il sistema di analisi dello sperma assistito da computer CEROS II di Hamilton Thorne, abbiamo individuato tre potenziali candidati. Dopo un’ulteriore selezione utilizzando test di inseminazione, è rimasto un singolo polimero con uno specifico intervallo di pesi molecolari. Questo polimero è stato chiamato Matrix.
Matrix è stato ampiamente testato nei suini. I primi esperimenti hanno indicato che una singola inseminazione era sufficiente per far rimanere incinte le scrofe, contrariamente alla pratica attuale di due inseminazioni. Matrix nel mezzo di diluizione per lo sperma di suino è stato testato per oltre due anni in varie aziende agricole nei Paesi Bassi. La conclusione è stata che con una sola inseminazione, il mezzo con Matrix aumentava il tasso di parto del 2-4% e aumentava la dimensione della cucciolata di 0,9-1,7 suinetti per cucciolata.
Sfortunatamente, le grandi aziende che producono e vendono diluenti per sperma e materiali di consumo per l’IA non erano interessate a Matrix perché avrebbe sempre ridotto significativamente il loro fatturato. Dopotutto, era necessaria solo una inseminazione una volta invece di due.
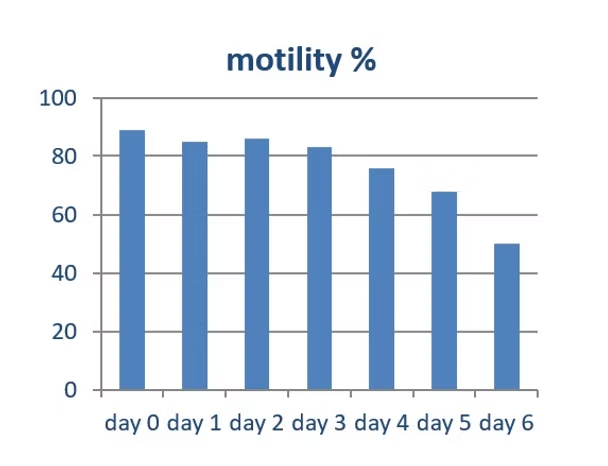
Dopo aver studiato l’uso di Matrix nei diluenti per sperma di suino, Barex ha iniziato a sviluppare un extender per sperma di coniglio. Nel 2015, Barex ha creato con successo Lepex. L’immagine sottostante dimostra la motilità dello sperma di coniglio diluito in Lepex durante la conservazione a 17°C.
Matrix ha mostrato un effetto positivo sulla capacità di conservazione di Lepex. Questo e altri esperimenti hanno dimostrato che Lepex ha una migliore capacità di conservazione rispetto ad altri extender per sperma di coniglio commerciali.
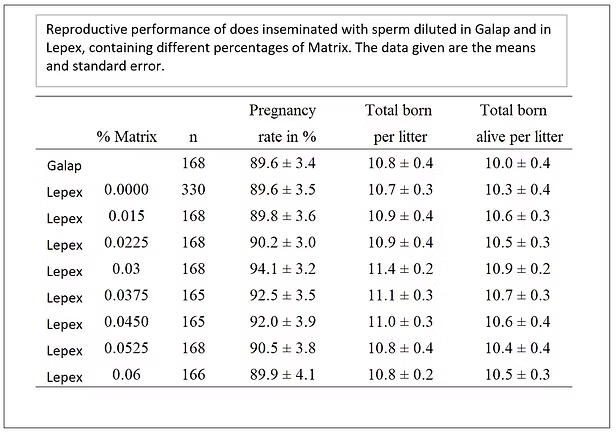
Ci si aspettava che Matrix avesse anche un effetto positivo sulla resa riproduttiva dei conigli. Dopo diversi esperimenti esplorativi, la percentuale ottimale di Matrix è stata determinata in una sperimentazione su larga scala.
L’immagine sottostante mostra i risultati. Alla concentrazione ottimale di Matrix, il tasso di gravidanza è del 4-5% superiore e la dimensione della cucciolata nata viva è quasi uno superiore rispetto a un extender senza Matrix.
Porex, porexcell e pronexcell.
Molti anni fa, Barex ha scoperto accidentalmente l’effetto positivo degli isolati di siero di latte sulla capacità di conservazione degli estensori di sperma suino. L’aggiunta dell’1% di una particolare marca di isolato di siero di latte è stata chiamata Porex. Porex è stato testato in TRIXCell, l’estensore di IMV Technologies. TRIXcell+ era l’estensore con Porex. Durante i sei anni di prove di inseminazione, le 35 aziende agricole che hanno partecipato hanno avuto ogni anno un tasso di parto più elevato e un numero maggiore di suinetti nati vivi quando è stato utilizzato TRIXcell+ invece di BTS, l’estensore di riferimento, con conseguente tasso di parto più elevato e una dimensione della cucciolata maggiore.
TRIXcell+ ha mostrato un aumento medio del numero di suinetti nati vivi pari a 0,6. Studi precedenti avevano indicato che TRIXcell aveva prestazioni simili a BTS in termini di tasso di parto e dimensioni della cucciolata (Haugan et al., 2007).
L’additivo all’estensore è stato chiamato Porex. Un ulteriore miglioramento di Porex è stata l’aggiunta di lecitina di soia. Con l’aggiunta, il nome è stato cambiato in Porexcell. Sia Porex che Porexcell sono stati utilizzati per molti anni negli estensori di sperma suino.
Intorno al 2014, è diventato evidente che l’effetto positivo di Porexcell è diminuito e ha persino influito negativamente sulla capacità di conservazione degli estensori di sperma suino. Si è scoperto che conteneva sempre più pesticidi nel corso degli anni. Questo effetto negativo sulla motilità durante la conservazione dello sperma diluito non era evidente negli estensori di sperma di stallone o negli estensori di sperma di coniglio. Sembra che le cellule spermatiche suine siano altamente suscettibili ai pesticidi. Sono stati compiuti sforzi per sviluppare un prodotto senza pesticidi; poiché non volevamo che lo sviluppo influenzasse le cellule spermatiche di stallone e coniglio, alla fine siamo passati a una miscela di proteine derivata dal latte ma più pura delle proteine del siero di latte. Il nuovo prodotto è stato chiamato Pronexcell. Ad oggi, Pronexcell è utilizzato negli estensori di sperma Hippex per lo sperma di stallone e in Lepex, l’estensore di sperma di coniglio.
Gli effetti positivi di queste proteine si aggiungono alle prestazioni di Matrix.
8. Matrixcell.
I risultati degli esperimenti iniziali hanno indicato che Novum funziona molto bene. Dovevano essere aggiunti ingredienti aggiuntivi per raggiungere prestazioni simili all’utilizzo di GnRH. Come scritto sopra, la proteina NGF interagisce con due recettori, TrkA e p75, che si trovano in tutto il tratto riproduttivo femminile per indurre l’ovulazione. Sono necessarie più attivazioni del recettore e la risposta è direttamente proporzionale al numero di incontri NGF-recettore per unità di tempo. Un’efficace trasduzione del segnale richiede concentrazioni adeguate e un ambiente biochimico adatto. Un estensore di sperma ha un ambiente biochimico molto diverso dal muco vaginale. La superficie del tratto riproduttivo femminile è ricoperta di muco, un complesso gel viscoelastico che funge da prima linea di difesa contro gli agenti dannosi provenienti dall’ambiente esterno. Il muco svolge un ruolo essenziale in molte funzioni biologiche. Il muco ospita la flora vaginale, fondamentale per mantenere la barriera mucosa vaginale. Per migliorare la miscelazione dello sperma diluito con il muco e per consentire a NGF di interagire con i suoi recettori, Matrixcell è uno degli ingredienti critici di Novum.
Matrixcell.
La somministrazione di NGF nel sito dei recettori nel tratto riproduttivo femminile può essere influenzata dal muco in numerose pieghe, cavità e creste nell’epitelio, che aumentano la superficie della vagina e forniscono distensibilità. Inoltre, la perdita può ridurre la quantità di NGF disponibile per l’interazione con i recettori. Con l’applicazione dell’IA, ci sono meno dinamiche dei fluidi vaginali e forze biomeccaniche naturali rispetto all’accoppiamento naturale.
Pertanto, l’efficacia dell’attività di NGF si basa su concentrazioni adeguate e ritenzione sulla superficie delle pareti del tratto riproduttivo. Matrix mucoadesivo si è dimostrato efficace, prolungando la presenza di NGF nella mucosa formando legami fisici e chimici con il muco. Tuttavia, per migliorare la penetrazione di NGF nel muco, è stato utilizzato Matrixcell, che è una forma più pura e raffinata di Matrix.
La penetrazione del muco comprende diverse fasi. La prima stabilisce un contatto intimo tra il mezzo di inseminazione e il muco e comporta la diffusione del mezzo. Nella seconda fase, si verifica un’interpenetrazione tra i polimeri di Matrix e le glicoproteine del muco formando intrecci fisici tra le due specie macromolecolari. In particolare, Matrixcell si comporta meglio di Matrix in questa fase, come indicato da esperimenti in vitro. Nella terza fase, si verifica il consolidamento, rafforzando il legame polimero-mucina di Matrix creando forze di Van der Waals e legami idrogeno.

9. Emivita di NGF
La presenza di peptidasi sia nello sperma diluito che nel tratto riproduttivo femminile influisce sull’emivita di NGF nella dose di inseminazione. Le peptidasi si trovano nel plasma seminale di coniglio, proveniente principalmente dall’epididimo e dalle ghiandole sessuali accessorie, mentre i microbi colonizzano il tratto riproduttivo femminile e secernono anche peptidasi. Sia lo sperma che il fluido vaginale contengono enzimi che degradano le proteine.
Matrixcell, presente nell’estensore, agisce come un gel per prolungare l’emivita di NGF. Inoltre, l’emivita delle proteine NGF è stata estesa aggiungendo un cocktail di inibitori degli enzimi che degradano le proteine, peptidi competitivi e proteine (a.o., Pronexcell).
10. Osservazioni conclusive
Le nuove conoscenze sulla riproduzione dei conigli hanno portato allo sviluppo del nuovo integratore per estensore di sperma Novum. I vari ingredienti unici di Novum supportano i meccanismi molecolari che portano all’ovulazione e alla gravidanza nel coniglio. L’eccellente performance di Novum è stata confermata da diversi esperimenti in diverse località in diversi paesi.

